郭德银/侯盼盼教授团队揭示冠状病毒DMV生成新机制
2025-11-2426近日,实验室特聘教授、广州国家实验室郭德银教授团队与实验室侯盼盼教授团队在Nature Communications在线发表题为“Coronaviral nsp6 hijacks ERAD machinery to facilitate lipolysis and supply membrane components for DMV growth”的研究论文。该研究揭示,冠状病毒nsp6蛋白能够将DMVs锚定于脂滴,并通过劫持ERAD途径降解脂滴表面蛋白PLIN2,进而将脂滴来源的脂肪酸(FAs)重新定向至DMVs,为其生长提供所需脂质。此外,nsp6还可将ERAD解离后衍生的双膜囊泡(EDMVs)锚定于DMV,为DMV膜扩张直接补充膜组分。
正链RNA病毒(包括冠状病毒)感染可诱导宿主细胞发生广泛的内膜系统重构,形成用于病毒复制的特殊膜结构,即病毒复制细胞器(Replication organelles, ROs)(1)。在冠状病毒感染过程中,病毒RNA的复制主要发生于特化的双膜囊泡(Double-membrane vesicles, DMVs)中。这些DMVs能够高效募集病毒蛋白及多种宿主因子,从而在促进病毒RNA高效合成的同时,协助病毒逃逸宿主天然免疫识别(2)。因此,靶向抑制DMV的形成可有效阻断冠状病毒复制,进而发挥抗病毒作用。已有研究表明,冠状病毒非结构蛋白nsp6在DMV形成过程中发挥关键作用,作为结构连接单元将DMV与内质网相连,并参与介导DMV与脂滴之间的相互作用(3)。然而,nsp6如何精确调控脂质运输以影响DMV的生成机制,目前尚未明确。
脂滴(LDs)是由磷脂单层包裹的细胞器,其主要功能是储存甘油三酯(TG)和胆固醇酯等中性脂质。脂滴自内质网起源,能够通过膜接触位点与多种细胞器发生互作,在脂质代谢与细胞能量稳态调控中起关键作用(4)。当内质网中出现错误定位或错误折叠的蛋白质时,这些蛋白可被识别并转运至胞质,经泛素化修饰后最终被递送至蛋白酶体降解,该过程被称为内质网相关降解(ER-associated degradation, ERAD),是维持内质网稳态的重要系统(5)。作为内质网质量控制系统的重要组成部分,ERAD蛋白组分属于短寿命调节因子,在完成靶蛋白降解后即被解离。解离后的复合物(含EDEM1与OS9)与SEL1L结合后脱离内质网,形成双膜包裹的囊泡结构,即EDEMosome(该研究将其命名为EDMVs)。
该研究揭示了一种此前未知的DMV形成与生长调控机制:在病毒感染早期阶段nsp6靶向结合脂滴,将DMV锚定于该类脂质储库,并通过招募ERAD机制驱动脂解过程,从而将脂肪酸(FA)从脂滴重新导向至DMV;在病毒高效复制阶段,在ERAD复合体解聚后,nsp6进一步动员来源自ERAD的囊泡(即EDMVs),直接为DMV的膜扩张提供结构组分(图1)。尤为重要的是,在包括SARS-CoV-2在内的多种冠状病毒中,干扰脂解过程或靶向ERAD通路均能显著抑制病毒复制与病毒颗粒的生成。这些发现具有重要的基础研究与转化医学意义:不仅揭示了病毒-宿主蛋白互作的新机制,阐明宿主蛋白质量控制机器在病毒复制细胞器形成中的关键功能,也为抗冠状病毒药物研发提供了新的潜在靶点。
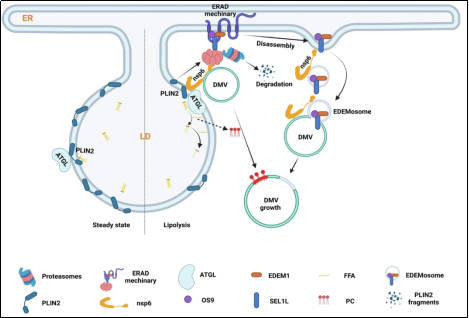
图1:nsp6与宿主降解机器互作协同调控DMV生长的示意图
因此,该研究系统阐明了冠状病毒双膜囊泡(DMV)生物合成的过程,揭示了病毒诱导的细胞器重塑过程及其在病毒复制中的功能意义,同时证实了病毒蛋白nsp6与宿主ERAD系统在DMV形成与生长中发挥的双重调控作用。鉴于DMVs结构在正链RNA病毒中具有高度保守性,靶向DMV生成有望成为开发广谱抗病毒疗法的一个重要且具有前景的策略方向,该课题组正在持续攻关中。
郭德银教授和侯盼盼教授为该文的共同通讯作者,广州国家实验室-中山大学联培博士生刘淑睿和深圳市第三人民医院周宇筝博后为该文的共同第一作者,研究得到中山大学医学院李春梅、潘纪安与广州国家实验室丁彬彬、马显才等教授的帮助。
论文原文:https://www.nature.com/articles/s41467-025-65118-y