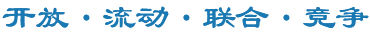Nat Microbiol | 赵金存教授团队发现首个通过O-糖基化修饰发挥广谱抗呼吸道病毒感染的干扰素刺激基因GALNT2
2025-12-12111呼吸道病毒,尤其是冠状病毒(CoVs)与甲型流感病毒(IAVs),是引发全球大流行并持续威胁人类公共卫生的主要病原体。引发COVID-19的SARS-CoV-2已导致全球超过700万人死亡,深刻影响了世界;新世纪首次流感大流行在2009年席卷全球,造成至少20万人死亡。面对病毒侵袭,人体的先天免疫反应,特别是干扰素(IFNs)及其诱导的下游干扰素刺激基因(ISGs),构成了抵御病毒的第一道防线。大量证据表明,I型干扰素(IFN-I)反应的延迟或受损是导致COVID-19和流感重症的关键标志。其中由IFN诱导的单个ISG是构成保护性抗病毒应答的重要组成部分,解析关键ISG如何抑制病毒感染,成为当前研究的焦点。2025年12月12日,赵金存教授团队在《Nature Microbiology》上发表题为“Interferon-stimulated gene GALNT2 restricts respiratory virus infections”的研究论文,首次系统阐明O-GalNAc糖基转移酶2(GALNT2)作为关键ISG,在SARS-CoV-2和IAV等呼吸道病毒感染中的发挥重要的抗病毒功能,为广谱抗病毒治疗提供新靶点。

为了探究关键ISG表达水平与COVID-19严重程度的相关性,该研究团队首先整合COVID-19患者支气管肺泡灌洗液(BALF)和外周血单核细胞(PBMC)的单细胞RNA测序数据,综合数据分析发现,GALNT2在COVID-19轻症患者气道上皮细胞和恢复期PBMC中的表达水平显著高于重症患者,提示GALNT2表达水平与病毒清除和感染进程密切相关。随后,该团队进一步分析已公开的全基因组关联分析(GWAS)数据,研究人员发现携带GALNT2基因单核苷酸多态性(SNP)与COVID-19和IAV感染的易感性、严重程度、住院风险等高度相关(图1)。以上研究结果提示,GALNT2在病毒感染中可能发挥重要的抗病毒作用。

图1. GALNT2表达水平与COVID-19疾病严重程度相关
体外和体内功能实验进一步证实,过表达GALNT2可以显著抑制SARS-CoV-2(包括WT和Omicron变异株)、HCoV-OC43、HCoV-229E以及多种亚型IAV(包括H1N1、H3N2、H9N2)的复制。相反,敲除内源性GALNT2则导致病毒复制显著增强,在敲除细胞系中回补GALNT2可有效限制病毒的感染。该团队发现GALNT2能在病毒感染时通过干扰素途径诱导,认为其作为新型ISG在病毒感染中发挥广谱抗病毒活性。基于细胞实验结果,该研究团队构建了GALNT2 KO小鼠,发现内源性GALNT2敲除显著增强病毒的感染,表现为更多的体重减轻、更低的存活率以及更高的病毒复制滴度。相反,使用AAV9载体滴鼻过表达GALNT2(AAV9-GALNT2)可明显减轻病毒感染的严重程度。值得关注的是,该团队在天然免疫缺陷的IFNAR KO和STAT1 KO小鼠中过表达GALNT2,都可显著降低SARS-CoV-2复制滴度,证明过表达GALNT2可以为免疫缺陷的群体提供有效保护(图2)。
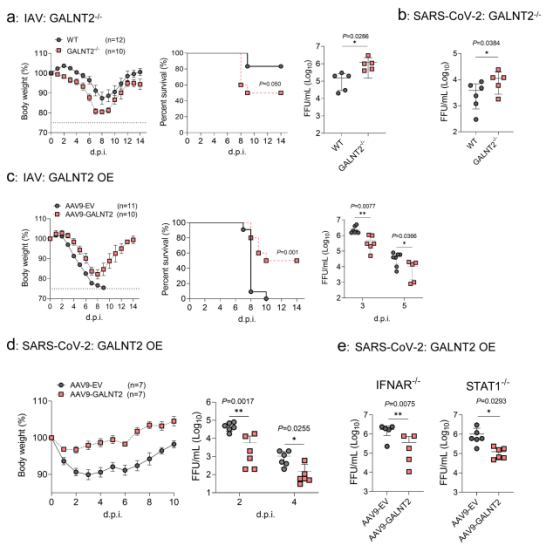
图2. GALNT2在体内保护小鼠拮抗SARS-CoV-2和IAV感染
机制研究表明,GALNT2作为O-GalNAc糖基转移酶,直接O-糖基化修饰SARS-CoV-2刺突蛋白(Spike, S)的S810和S813位点,阻碍蛋白酶(TMPRSS2)对Spike S2’的切割,进而抑制病毒与宿主细胞的膜融合过程。同样,GALNT2可O-糖基化修饰IAV血凝素(HA)蛋白的裂解位点,阻断其蛋白切割与融合功能。本研究进一步使用cell-cell fusion、假病毒包装、类病毒颗粒(VLP)感染等方法,验证被GALNT2 O-糖基化修饰的子代病毒入侵功能受损,这揭示了GALNT2在病毒多轮复制中发挥抗病毒作用的分子机制(图3)。

图3. GALNT2依赖的O-糖基化修饰SARS-CoV-2 Spike和IAV HA
值得注意的是,该研究运用反向遗传技术,进一步发现病毒难以通过简单突变逃逸GALNT2的抗病毒作用。虽然S810/813位点突变病毒(S810/813A,S810/813I)在细胞和小鼠水平能逃逸GALNT2的抗病毒作用,但这些突变同时严重损害了病毒自身的复制能力和膜融合效率。这解释了为何自然演化中出现的相关突变株会迅速消失(图4)。因此,Galnt2作用靶点非常保守,而且病毒无法简单通过突变逃逸其抗病毒作用,为广谱抗病毒药物开发提供了全新视角。
图4. S810/813是介导GALNT2抑制SARS-CoV-2感染的主要靶点
总之,这项研究首次系统性揭示GALNT2为一个由干扰素诱导、具有广谱抗病毒活性的关键效应分子,通过O-糖基化修饰病毒膜蛋白发挥抑制病毒感染入侵的全新机制。本研究不仅深化了对宿主-病毒相互作用的理解,也为开发针对新冠病毒、流感病毒等呼吸道病原的广谱抗病毒策略提供了新靶点与理论基础。
赵金存教授、汪少伯研究员、中山大学毛洋教授、肇静娴教授、美国爱荷华大学Stanley Perlman教授、清华大学丁强教授为共同通讯作者。广州医科大学/广州实验室冉伟副研究员、博士研究生杨惊鸿、喻实副研究员、胡庆涛副教授、中山大学博士研究生何羽骐为共同第一作者。本研究获得科技部重点研发计划、国家自然科学基金等多个项目的资助和支持。
论文原文:https://www.nature.com/articles/s41564-025-02200-7