王健、杨凯团队在DNA损伤修复异常导致肺动脉高压的机制研究中取得新进展
2025-06-0939872025年6月6日,王健/杨凯团队在呼吸与危重症医学领域顶刊Am J Respir Crit Care Med(IF=19.3)发表了题为“Deficient FANCL Predisposes Endothelial Damage: A New Therapeutic Target for Pulmonary Hypertension”的原创研究论文,首次报道了范可尼DNA修复通路核心因子FANCL下调可诱导DNA损伤积聚并导致TGF-β超家族的亚通路失衡,在内皮细胞损伤和肺血管重塑中发挥关键作用。回补FANCL表达、保护DNA损伤或抑制TGF-β通路可显著改善肺动脉高压进程,为该类疾病的防治提供了新策略。王健教授和杨凯教授、北京大学生命科学学院徐冬一研究员、湖北大学生命科学学院许鑫璘博士为论文共同通讯作者,实验室2024届博士毕业生刘诗韵、2023届联合培养硕士毕业生单晓茜、2023级在读硕士生孙宇菲、2021届硕士毕业生陈海霞、2023级在读博士生冯华焯为论文共同第一作者。

【研究背景】
肺动脉高压是一种严重的心肺血管疾病,严重威胁人类健康。I型动脉性肺动脉高压(PAH)表现为肺血管阻力增加和闭塞性动脉重塑、存在丛状病变和肺小血管丢失。近年来的研究表明:烷化剂类化疗药的使用可导致DNA损伤修复异常并与PAH发病和肺血管损伤密切相关。烷化剂可诱导DNA链间交联(ICL)和双链断裂(DSB)发挥遗传毒性,而这些损伤可被范可尼DNA修复通路(FA)识别和修复。ICL的形成可触发FA核心复合体的募集,并由E3泛素连接酶FANCL对关键活性因子FANCI和FANCD2进行单泛素化修饰并促进其形成异源二聚体发挥修复功能。然而FA通路在PAH进展中是否存在功能缺陷及其作用如何尚不明确。本研究拟使用生物信息学分析、PAH患者来源的组织或细胞、FANCL缺陷小鼠、AAV介导的FANCL回补等多种工具系统探索FANCL在内皮损伤和烷化剂诱导的PAH中的功能及潜在调控机制。
【研究结果】
1、FANCL在PAH肺血管内皮细胞中显著下调
基于已发表的PAH患者单细胞数据库分析发现:在众多DNA损伤修复基因中,FANCL在PAH患者内皮细胞中较对照组显著下调。随后使用特发性肺动脉高压(IPAH)和肺静脉闭塞症(PVOD)等不同亚型PAH患者来源的肺组织和肺动脉内皮细胞(PAECs),以及野百合碱(MCT)诱导的PAH大鼠模型肺组织对FANCL的下调予以证实。且FANCL的下调伴随DNA损伤和细胞凋亡标志物的显著上调,提示其可能存在潜在关联。
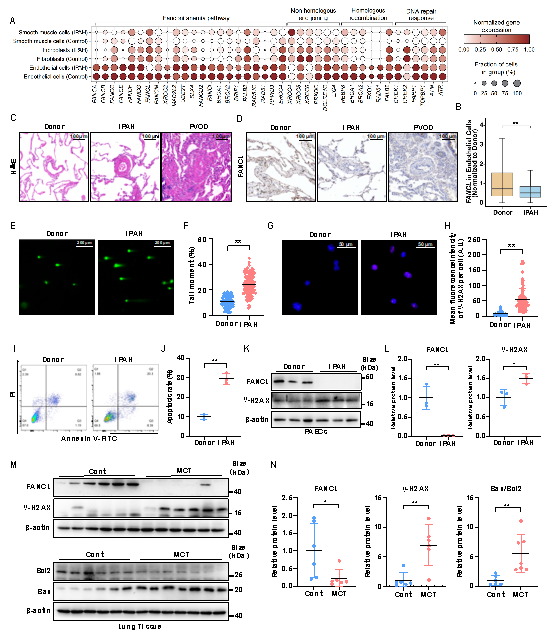
图1:FANCL在PAH患者和动物模型中显著下调
2、FANCL缺陷可自发肺小血管重塑并加重烷化剂诱导的PAH表型
研究发现,FANCL缺陷小鼠(Fanclkf/kf)可自发表现出广泛累及肺小动/静脉的毛细血管前/后血管重塑,并显著加剧烷化剂丝裂霉素C(MMC)诱导的PAH表型,如右心室收缩压、右心肥厚指数、超声心动图右心功能评估及肺小血管网络结构分析等,提示FANCL缺陷可作为独立风险因素或协同MMC促进肺血管重塑和PAH的发生。

图2:FANCL缺陷诱导肺小血管损伤并加剧PAH进程
3、FANCL缺陷可诱导肺内皮细胞TGF-β/BMP通路失衡
与FANCL缺陷加重内皮细胞损伤相对应的是转录层面显著的TGF-β/BMP通路失衡,表现为TGF-β通路的整体上调和BMP通路的整体抑制。使用免疫组化染色和ELISA证实了TGF-β1在FANCL缺陷和MMC诱导的模型小鼠肺组织和MMC处理PMVECs上清中的高表达。

图3:FANCL缺陷诱导显著的TGF-β/BMP通路失衡
4、TGF-β/BMP通路失衡在PMVECs损伤中发挥关键作用
接下来,通过信号通路转导及功能验证进一步探究TGF-β/BMP通路失衡模式及其在PMVECs损伤表型中的贡献。使用各组模型小鼠分离培养的PMVECs作为研究对象分别利用TGF-β1、BMP9或Activin A重组蛋白进行处理,一方面,检测20分钟内下游信号转导(Smad2/3和Smad1/5/9)的活化情况及12小时内下游靶基因(Id1和Pai1)的转录表达情况;另一方面,分别使用小分子化合物P144和中和抗体1D11两种TGF-β抑制剂探究其对MMC所致内皮损伤的潜在保护作用。系列结果证实了内皮细胞TGF-β通路的活化和BMP通路的抑制,且TGF-β抑制剂可显著抑制MMC诱导的内皮细胞功能改变。值得注意的是,尽管转录组测序结果提示FANCL缺陷和MMC干预对Activin通路同样存在潜在抑制作用,然而,使用当下备受关注的Activin配体陷阱类新型PAH治疗药物索他西普(ACE-011)处理却获得了与TGF-β抑制剂相似的保护效果。ACE-011同样可显著抑制MMC诱导的内皮凋亡和功能异常,为该类药物在高DNA损伤PAH亚型中的潜在疗效提供了初步实验证据。

图4:FANCL诱导的TGF-β/BMP通路失衡促进肺血管内皮损伤
5、AAV-FANCL回补显著改善多种PAH模型进展
为了进一步评估FANCL在PAH发病中的作用,使用AAV气道滴注实现FANCL回补,分别检测其对于FANCL缺陷和MMC诱导的PAH小鼠模型的潜在治疗作用。右心室收缩压、右心肥厚指数、超声心动图右心功能评估和肺血管病理评估等结果均提示AAV-FANCL回补可显著改善FANCL缺陷联合MMC诱导的PAH表型。AAV-FANCL回补同样对MCT诱导的PAH大鼠模型表现出良好的治疗效果。

图5:AAV-FANCL回补显著改善FANCL缺陷联合MMC诱导的PAH表型
6、DNA损伤保护剂Amifostine显著改善FANCL缺陷联合MMC诱导的PAH进展
此外,使用前期报道过的DNA损伤保护剂Amifostine评估其对于FANCL缺陷联合MMC诱导的PAH小鼠模型的潜在疗效。与AAV-FANCL回补结果类似,肺血流动力学和病理生理学检测均提示Amifostine同样可以显著改善FANCL缺陷联合MMC诱导的PAH表型。

图6:Amifostine显著改善FANCL缺陷联合MMC诱导的PAH表型
【研究结论】
该研究首次报道了FA通路核心因子FANCL的异常下调可作为重要风险因素诱发TGF-β超家族亚通路失衡并加重烷化剂诱导的肺血管重塑和PAH;通过AAV病毒实现FANCL回补或使用DNA损伤保护剂Amifostine可显著改善FANCL缺陷或联合MMC诱导的PAH表型,为该类疾病的防治提供了新思路。

广州医科大学附属第一医院、呼吸疾病全国重点实验室为本文第一完成单位。本研究得到了国家自然科学基金、科技创新2030 –“四大慢病”国家科技重大专项、国家重点研发计划、广州国家实验室重点专项、呼吸疾病全国重点实验室自主课题和广州医科大学南山学者启动基金资助。
参考文献:
Liu S, Shan X, Sun Y, Chen H, Feng H, Mo S, Bao C, Zhu J, Zhang Z, Wei F, Bai X, Xu R, Lai J, Luo H, Zhang C, Luo X, Jiang Q, Chen Y, Zhou Y, Tang H, Xu L, Lu W, Guo R, Liu C, Yang Z, Yuan JX, Xu X, Xu D, Wang J, Yang K. Deficient FANCL Predisposes Endothelial Damage: A New Therapeutic Target for Pulmonary Hypertension. Am J Respir Crit Care Med. 2025 Jun 6. Epub ahead of print. PMID: 40479584.
论文原文:https://www.atsjournals.org/doi/abs/10.1164/rccm.202408-1655OC