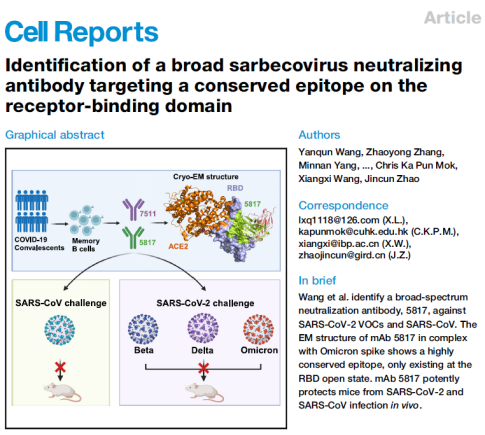
赵金存教授团队发现沙贝病毒保守中和表位,并证实其靶向抗体在体内可有效抵御SARS-CoV和SARS-CoV-2感染
2024-01-085662近年来,沙贝病毒(Sarbecovirus)不断出现新成员,其成员致病性和传播力往往高于其他人冠状病毒,典型代表是2003年的非典病毒(SARS-CoV)和2019年的新冠病毒(SARS-CoV-2),且未来可能出现的高风险冠状病毒也主要分布在该属,沙贝病毒的广谱疫苗和广谱中和抗体开发一直是研究热点,其中沙贝病毒属交叉抗体的保守表位分布和抗体的体内外保护性机制亟需进一步解析,以加快广谱疫苗和药物研发。赵金存教授团队与国内多家单位合作,利用EBV转化方法筛选获得多株沙贝病毒交叉抗体,其中5817抗体可广泛地中和沙贝病毒属中的多种病毒以及新冠病毒的多个变异毒株,其靶向的表位在沙贝病毒属中表现出高度保守性,并且在多种沙贝病毒小鼠攻毒保护试验中表现出有效的保护能力。相关成果在国际期刊Cell Reports上发表题为 “Identification of a broad sarbecovirus neutralizing antibody targeting a conserved epitope on the receptor-binding domain”的学术论文。
本项目研究利用新冠康复者PBMC、EBV转化法以及中和实验,从大量新冠病毒特异性B细胞中直接筛选获得沙贝病毒广谱中和抗体,ACE2-RBD 阻断实验证明5817抗体可不同程度地广谱阻断沙贝病毒与受体结合;表位竞争实验表明,5817抗体与已发表的6种类型RBD靶向抗体不存在明显竞争;多项结果均表明5817抗体表现出特殊的中和或抑制特性,其靶向表位在沙贝病毒属中具有保守性,值得进一步探究(图1)。
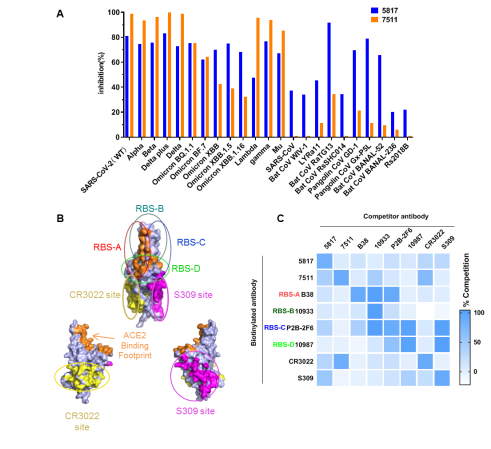
图1. 5817抗体特性分析,包括与多种沙贝病毒RBD-ACE2的阻断效果分析及针对新冠病毒6类RBD靶向中和抗体的竞争分析
抗原-抗体复合物的冷冻电镜结构解析发现5817抗体靶向表位在沙贝病毒属群体中相对保守,位于RBD与受体ACE2的关键结合部位的背面,识别RBD处于“打开”状态下的表位;中和实验表明5817类抗体针对新冠病毒的多种变异毒株不存在明显的免疫逃逸现象,5817抗体在RBD上的关键结合位点在病毒突变监测分析中也显示出极低的突变频率,其广谱特性对于药物和疫苗开发有指导借鉴意义(图2)。
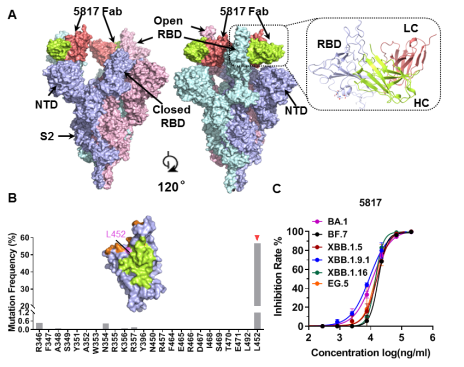
图2. 5817抗体识别保守隐匿表位,其关键结合位点高度保守,突变率低,具有广谱中和特性
体细胞超突变分析发现5817类抗体经过了一定的体细胞超突变,且直接影响了抗体最终的亲和力;人群血清学分析表明,在新冠疫苗免疫人群和新冠康复者中均可以发现一定比例的5817抗体类似表位的相关抗体,说明5817类抗体不存在人群特异性(图3)。
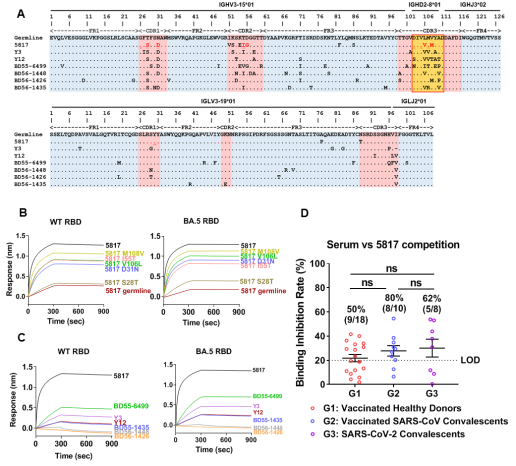
图3. 5817抗体的进化。5817胚系基因的超突变影响了其亲和力成熟,不同人群中均存在5817类似表位的抗体
小鼠体内保护实验表明5817类抗体可有效预防和治疗新冠不同变异毒株在小鼠上的感染,包括Beta、Delta和Omicron毒株;此外非典病毒小鼠感染模型也表明5817类抗体在预防病毒感染中表现出100%存活率,治疗组中也显著地降低了肺部滴度,证实5817类抗体能在体内中有效地抵御多种沙贝病毒的感染(图4)。
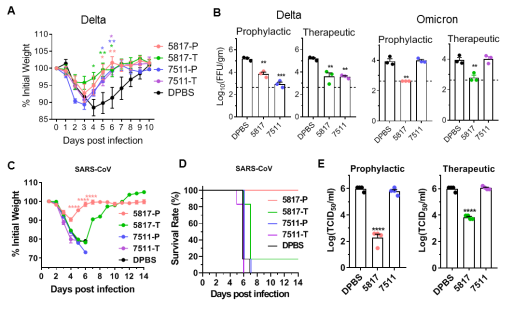
实验室王延群教授、张昭勇博士、颜奇鸿博士,中科院生物物理所曹磊副研究员、杨闽楠博士,上海科技大学熊昕沂博士为本文共同第一作者;赵金存教授、刘晓青教授、中科院生物物理所王祥喜教授、香港中文大学Chris Mok教授为共同通讯作者。本研究获得科技部应急专项和国家自然科学基金等多个项目的支持。
原文链接:
Wang Y, Zhang Z, Yang M, Xiong X, Yan Q, Cao L, Wei P, Zhang Y, Zhang L, Lv K, Chen J, Liu X, Zhao X, Xiao J, Zhang S, Zhu A, Gan M, Zhang J, Cai R, Zhuo J, Zhang Y, Rao H, Qu B, Zhang Y, Chen L, Dai J, Cheng L, Hu Q, Chen Y, Lv H, So RTY, Peiris M, Zhao J, Liu X, Mok CKP, Wang X, Zhao J. Identification of a broad sarbecovirus neutralizing antibody targeting a conserved epitope on the receptor-binding domain. Cell Rep. 2024 Jan 3;43(1):113653. doi: 10.1016/j.celrep.2023.113653. Epub ahead of print. PMID: 38175758.
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01664-9