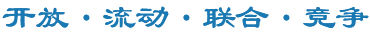钟南山院士、王健教授团队研究揭示新冠病毒刺突蛋白驱动肺血管内皮损伤的分子机制
2023-07-196253自2019年底以来,新型冠状病毒SARS-CoV-2感染导致的COVID-19全球大流行给人类健康造成了巨大威胁。在当前与病毒长期共存的大趋势下,对于长新冠后遗症的防治与管理成为社会关注的核心问题。SARS-CoV-2感染可诱导患者发生严重的肺血管内皮病变,其特征是内皮细胞损伤和微血栓形成。研究表明,SARS-CoV-2刺突蛋白与内皮细胞的相互作用及随后诱导的微环境变化足以驱动肺血管内皮的损伤和功能障碍,然而其具体分子机制尚需进一步研究证实。
2023年7月14日,广州医科大学呼吸疾病全国重点实验室,广州实验室钟南山院士和王健教授团队在Nature旗下刊物Signal Transduction and Targeted Therapy(中科院医学1区Top期刊,IF=39.3)在线发表了题为“SARS-CoV-2 Spike Protein Receptor-Binding Domain Perturbates Intracellular Calcium Homeostasis and Impairs Pulmonary Vascular Endothelial Cells”的研究论文,该研究揭示了钙池操纵性钙通道SOCC和机械敏感性离子通道Piezo1的异常表达和活化在SARS-CoV-2刺突蛋白诱导肺血管内皮损伤和血管重塑中发挥重要作用,为SARS-CoV-2所致肺血管疾病的防治提供了新机制和新靶点。实验室钟南山院士、王健教授、杨凯教授为论文并列通讯作者,杨凯教授、博士研究生刘诗韵和颜涵、卢文菊教授为论文并列第一作者。

首先,在体外培养的人肺动脉内皮细胞(PAECs)中,SARS-CoV-2刺突蛋白受体结合域(S-RBD)急性暴露(1、2h)可通过激活TRPV4通道活性诱发细胞外钙离子内流从而提高细胞内游离钙离子浓度([Ca2+]i);而慢性S-RBD暴露(24、72h)则可通过激活Piezo1和SOCC通道活性上调PAECs中的钙离子水平。
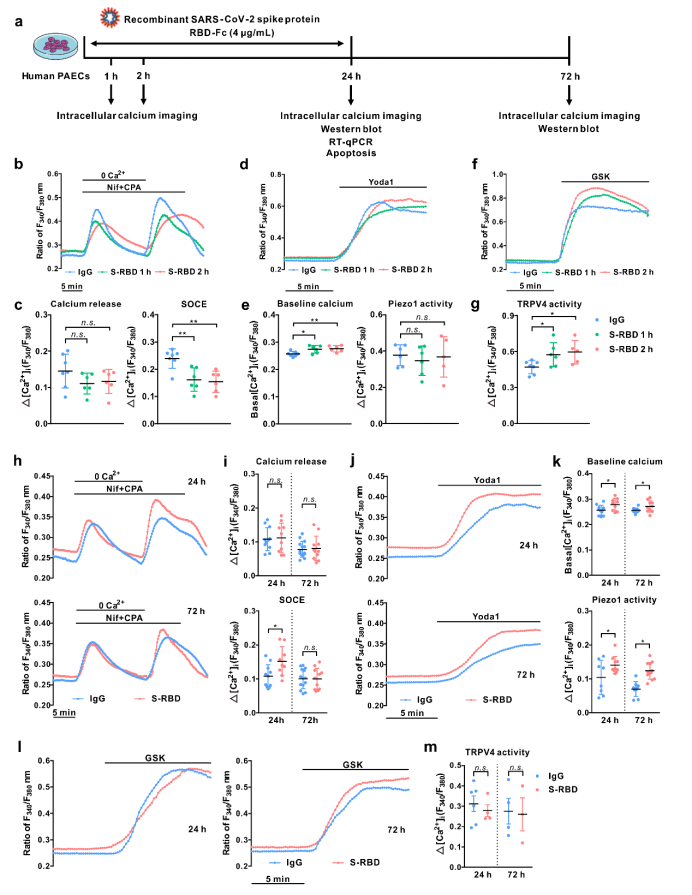
其次,通过分析人PAECs中相关钙通道Piezo1、TRPV4以及SOCC三种主要功能组分STIM1、TRPC1和Orai1的表达发现S-RBD慢性暴露(24、72h)可显著上调Piezo1和Orai1的蛋白表达。与此同时,使用siRNA特异性敲低Piezo1、Orai1或STIM1可显著抑制S-RBD诱导的胞内钙离子上调及细胞的过度凋亡。
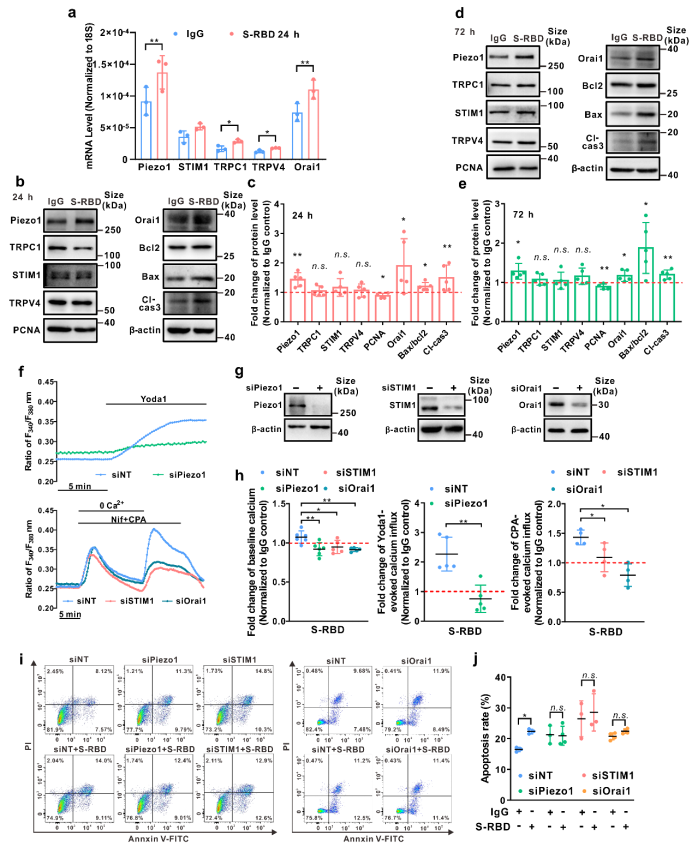
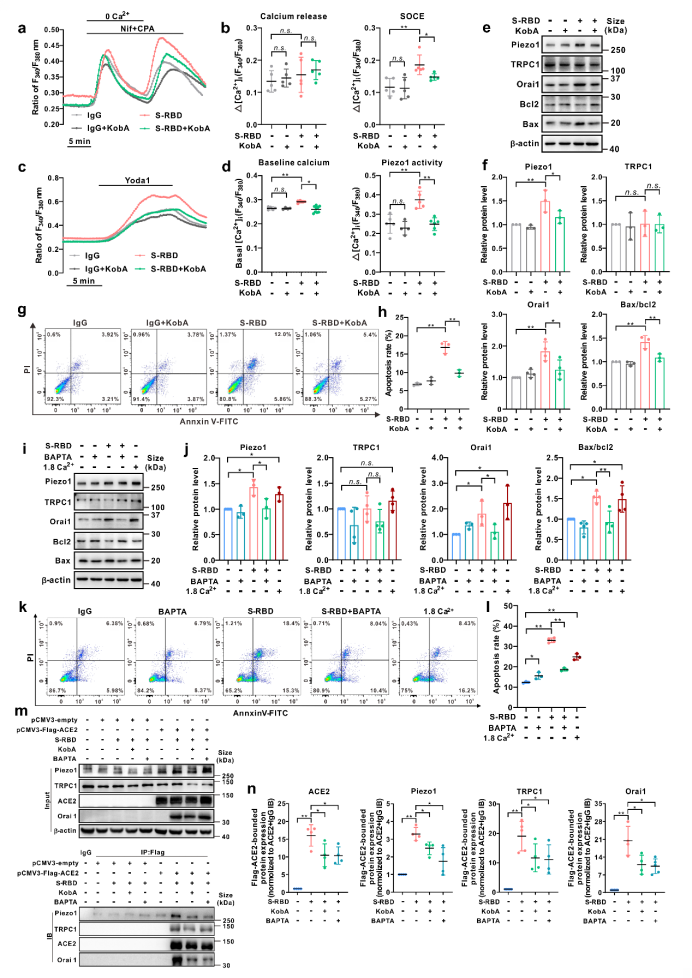
而使用抑制剂Kobophenol A(KobA)特异性阻断S-RBD与宿主细胞主要受体ACE2的相互作用或细胞内钙离子螯合剂BAPTA-AM(BAPTA)证实S-RBD诱导的PAEC细胞凋亡以及Piezo1和SOCC钙通道的上调和活化均依赖于S-RBD-ACE2的相互作用及细胞内钙离子的存在。在外源表达ACE2的HEK293T细胞中通过免疫共沉淀实验证实S-RBD暴露可通过结合宿主细胞ACE2诱导包含ACE2与Piezo1、Orai1和TRPC1等钙通道在内的聚合物的形成,促进Piezo1和SOCC等钙通道的上调和活化,继而导致细胞的凋亡。而KobA或BAPTA预处理均可显著抑制该过程的进展。
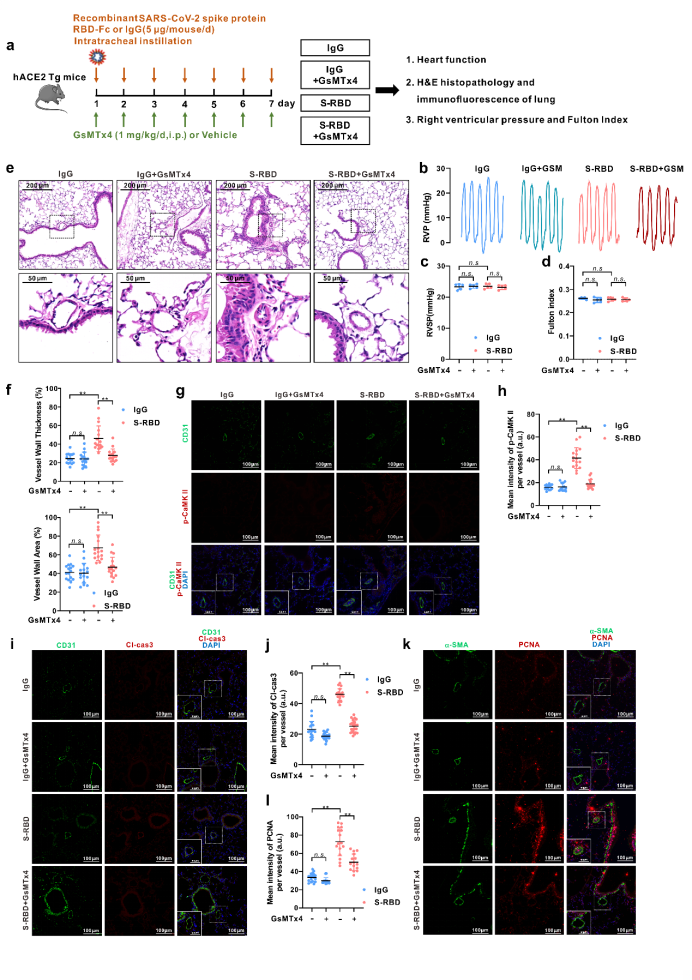
为了进一步阐明S-RBD对肺血管的影响,使用人源化ACE2转基因小鼠(hACE2 Tg)作为研究对象,利用S-RBD重组蛋白经气管插管连续滴注7天建立动物模型。一方面,与IgG对照组相比,S-RBD可诱导显著的肺小血管增厚和重塑,并伴随肺血管内皮的过度凋亡和平滑肌的过度增殖;另一方面,使用GsMTx4抑制Piezo1与SOCC活性可显著缓解S-RBD诱导的肺血管重塑和内皮损伤。
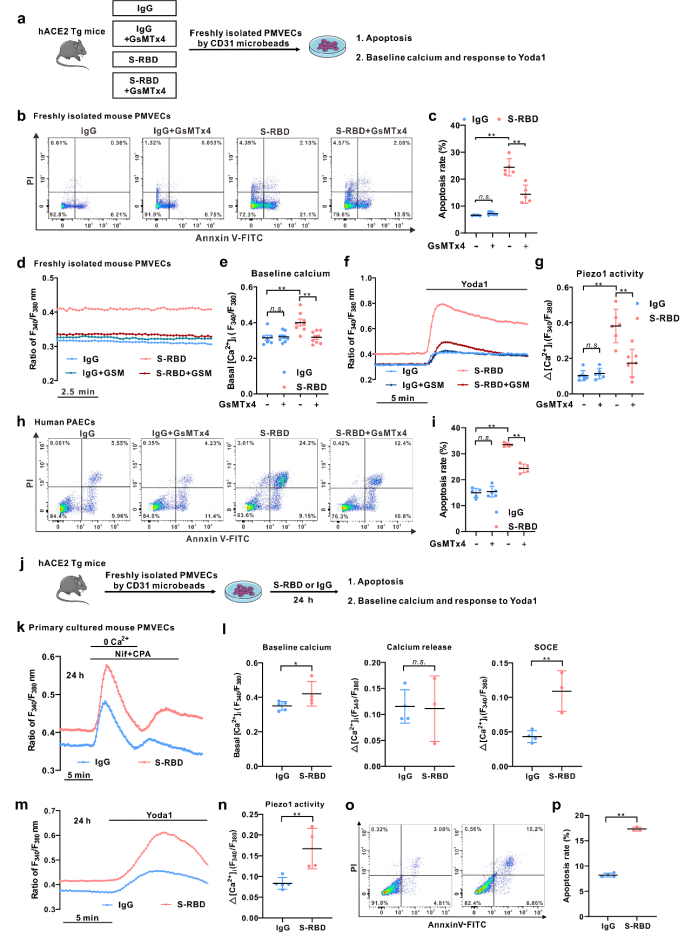
接下来,为了更好地评估各组模型小鼠中肺血管内皮细胞的表型及功能,利用磁珠分选技术新鲜分离和培养各组模型小鼠的肺微血管内皮细胞(PMVECs)。结果显示:一方面,S-RBD滴注模型组新鲜分离的PMVECs表现出显著升高的细胞内钙离子和凋亡水平,而相关表型在GsMTx4处理组分选的细胞中则得到显著改善。另一方面,在正常hACE2 Tg小鼠分离培养的PMVECs中,S-RBD慢性暴露同样可以诱导显著升高的细胞内钙离子和凋亡水平。
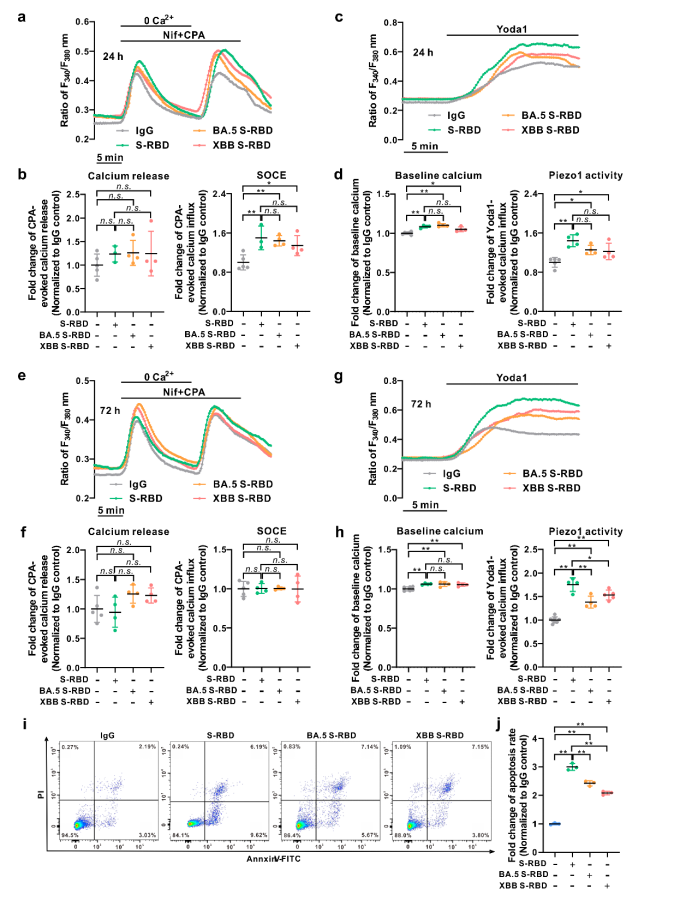
此外,该研究还比较了不同突变株来源的S-RBD,如Omicron(BA.5.2和XBB)对人PAECs细胞内钙稳态调控和细胞凋亡的影响发现:与原始毒株S-RBD相比,Omicron突变株(BA.5.2和XBB)S-RBD诱导的细胞凋亡水平显著降低,但基础钙水平相当,而SOCE和Piezo1通道活性略有下降。
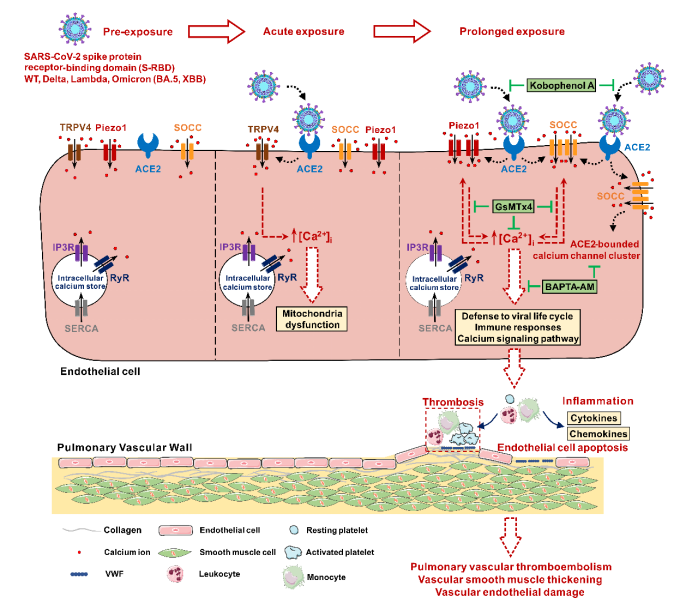
该研究首次报道了S-RBD暴露可通过上调和激活Piezo1和SOCC等钙通道促进肺血管内皮细胞钙离子浓度的升高,从而诱导肺血管内皮细胞的过度凋亡和肺血管的异常重塑。靶向抑制宿主细胞ACE2-Piezo1/SOCC-[Ca2+]i信号轴可能是对抗S-RBD(甚至SARS-CoV-2)诱导的肺血管损伤的新型有效治疗方法,为长新冠肺血管并发症的防治和管理提供了新思路和新策略。
本研究得到了国家自然科学基金重点国合项目、重点专项项目和面上项目、科技部重点研发计划、教育部长江学者创新团队项目、广东省珠江人才计划本土创新科研团队项目、广东省自然科学基金等项目的资助。