PNAS丨赵金存团队成功构建人冠状病毒229E和NL63感染小鼠动物模型,并阐明与SARS-CoV-2感染存在交叉免疫保护
2023-01-216419人冠状病毒HCoV-229E和HCoV-NL63是季节性感冒病毒,可在全球范围内流行,主要感染人上呼吸道,引起普通感冒症状【1-2】。但在免疫力低下的人群,如儿童、老年、免疫缺陷病人,可引起重症肺炎和支气管炎,甚至死亡【3-6】。少数健康成年人感染229E后也可发展为急性呼吸窘迫综合症【7】。我们团队前期研究表明,NL63正在活跃进化,新亚型可在儿童中引起重症肺炎【8】。然而,由于目前缺乏229E和NL63小鼠动物模型,导致229E、NL63感染,尚无特效药物和疫苗。而其和目前正在大流行SARS-CoV-2 是否存在交叉体液和细胞免疫应答尚不清楚。
1月18日,广州医科大学附属第一医院/呼吸疾病国家重点实验室赵金存教授团队与香港大学Malik Peiris教授,广州海关技术中心国家生物安全检测重点实验室(P3实验室)合作,在PNAS杂志在线发表了题为Mouse models susceptible to HCoV-229E and HCoV-NL63 and cross protection from challenge with SARS-CoV-2 的研究成果。作者利用表达229E和NL63受体的腺病毒载体,滴鼻转导不同遗传背景小鼠,快速构建229E和NL63易感小鼠模型。此动物模型可应用于广谱抗病毒药物和疫苗评估,并且在体内水平上阐明229E、NL63冠状病毒和新冠病毒之间存在交叉保护作用,为冠状病毒致病机制研究提供平台。

229E的受体是氨基肽酶(aminopeptidase N,APN)【9】,NL63、SARS-CoV和SARS-CoV-2的受体均是血管紧张素转化酶2(angiotensin-conveting enzyme 2,ACE2)【10-14】。在这项研究中,研究团队利用腺病毒载体,在IFNAR-/-和STAT1-/-小鼠肺脏中分别表达229E受体hAPN和NL63受体hACE2,转导5天后感染229E和NL63。感染后,小鼠肺部出现间质性肺炎表现,病毒可持续复制7天左右。229E和NL63易感小鼠可产生病毒特异性T细胞应答和中和抗体。小鼠感染模型给予瑞德西韦治疗,可加速病毒的清除。利用分别表达229E-S或者NL63-S蛋白的委内瑞拉马脑炎病毒疫苗载体(VEE Replicon Particle,VRP)免疫小鼠,同样可加速病毒清除。表明构建的229E和NL63易感小鼠可用于药物和疫苗评估。
进一步,为了探究229E和NL63感染是否对高致病性冠状病毒SARS-CoV-2存在交叉免疫保护反应,研究团队利用229E和NL63感染小鼠,并在感染记忆期,再次感染SARS-CoV-2。结果显示,与对照组相比,预先感染229E和NL63可减少小鼠体重下降并加速病毒清除,并减轻肺脏病理损伤。过继转移229E和NL63感染恢复期血清未产生保护作用,而感染SARS-CoV-2前利用删除抗体将CD4+和CD8+ T细胞删除,可延缓SARS-CoV-2的清除,提示交叉免疫保护反应可能由交叉反应性T细胞介导(见图1)。
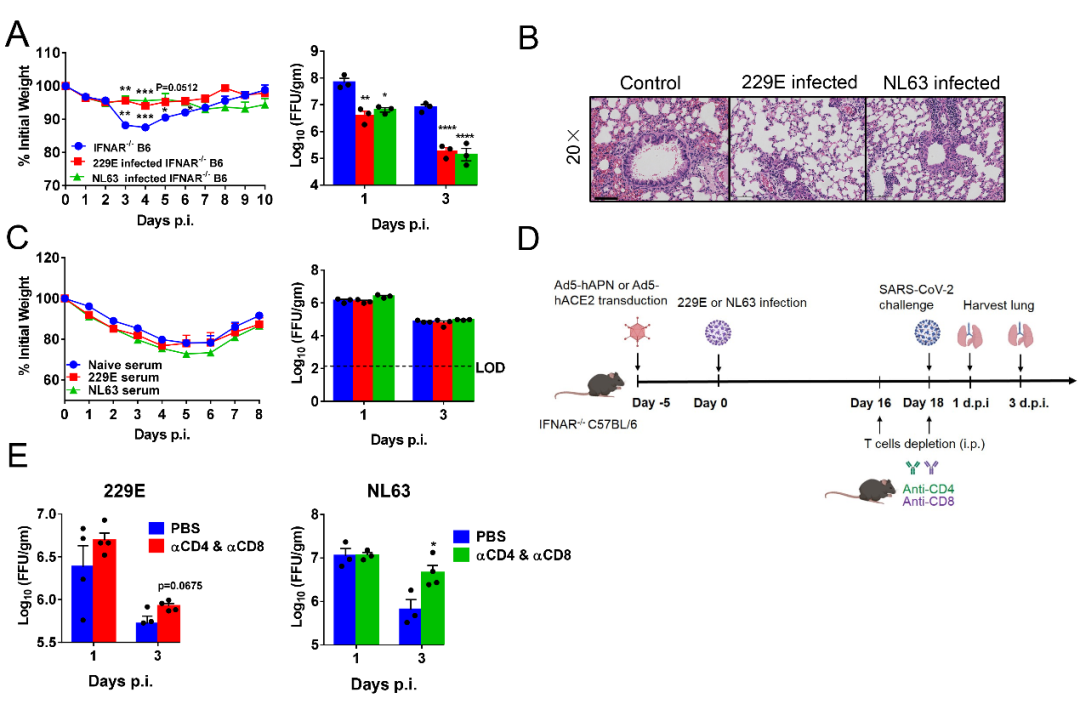
图1.229E和NL63易感小鼠可以部分抵抗SARS-CoV-2的感染。
实验室赵金存教授、肇静娴教授,香港大学Malik Peiris教授为本文共同通讯作者,广州医科大学附属第一医院/呼吸疾病国家重点实验室刘冬兰博士、陈春可博士、陈锭彬博士、朱爱如博士、李芳博士、庄珍博士、香港中文大学莫家斌教授(Chris Ka Pun Mok)、广州海关技术中心国家生物安全检测重点实验室(P3实验室)戴俊博士、李小波博士、以及广州市妇女儿童医疗中心金颖康博士为本文并列第一作者。该研究得到了科技部和国自然等项目的资助。
参考文献
1. van der Hoek, L., Human coronaviruses: what do they cause? Antivir Ther, 2007. 12(4 Pt B): p. 651-8.
2. Davis, B.M., et al., Human coronaviruses and other respiratory infections in young adults on a university campus: Prevalence, symptoms, and shedding. Influenza Other Respir Viruses, 2018. 12(5): p. 582-590.
3. Pene, F., et al., Coronavirus 229E-related pneumonia in immunocompromised patients. Clin Infect Dis, 2003. 37(7): p. 929-32.
4. Walsh, E.E., J.H. Shin, and A.R. Falsey, Clinical impact of human coronaviruses 229E and OC43 infection in diverse adult populations. J Infect Dis, 2013. 208(10): p. 1634-42.
5. Gorse, G.J., et al., Human coronavirus and acute respiratory illness in older adults with chronic obstructive pulmonary disease. J Infect Dis, 2009. 199(6): p. 847-57.
6. Cui, J., F. Li, and Z.L. Shi, Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol, 2019. 17(3): p. 181-192.
7. Vassilara, F., et al., A Rare Case of Human Coronavirus 229E Associated with Acute Respiratory Distress Syndrome in a Healthy Adult. Case Rep Infect Dis, 2018. 2018: p. 6796839.
8. Wang, Y., et al., Discovery of a subgenotype of human coronavirus NL63 associated with severe lower respiratory tract infection in China, 2018. Emerg Microbes Infect, 2020. 9(1): p. 246-255.
9. Yeager, C.L., et al., Human aminopeptidase N is a receptor for human coronavirus 229E. Nature, 1992. 357(6377): p. 420-2.
10. Li, W., et al., The S proteins of human coronavirus NL63 and severe acute respiratory syndrome coronavirus bind overlapping regions of ACE2. Virology, 2007. 367(2): p. 367-74.
11. Zhou, P., et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020. 579(7798): p. 270-273.
12. Li, W., et al., Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 2003. 426(6965): p. 450-4.
13. Hoffmann, M., et al., SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell, 2020.
14. Hofmann, H., et al., Human coronavirus NL63 employs the severe acute respiratory syndrome coronavirus receptor for cellular entry. Proc Natl Acad Sci U S A, 2005. 102(22): p. 7988-93.
论文原文:https://www.pnas.org/doi/10.1073/pnas.2202820120