肺血管病学组在肺动脉高压发病机制领域取得系列研究成果
2021-04-0569092021年4月5日,实验室肺血管病学组王健教授课题组在循环和外周血管领域权威期刊Hypertension(医学1区Top期刊,影响因子:7.713)在线发表了题为“Upregulation of Piezo1 Enhances the Intracellular Free Calcium in Pulmonary Arterial Smooth Muscle Cells from Idiopathic Pulmonary Arterial Hypertension Patients”的原创研究(Original research)。研究揭示了机械敏感性离子通道Piezo1在正常和肺动脉高压条件下对肺动脉平滑肌细胞中钙稳态调节的潜在作用。实验室王健教授和杨凯副教授为本文的共同通讯作者,2018级硕士研究生廖静、卢文菊教授、陈豫钦博士为共同第一作者。

肺动脉高压(PAH)是一种以肺动脉压力和肺血管阻力进行性升高,继而累及右心功能为特点的心肺血管综合征,其病理生理学特征主要包括肺血管的异常收缩和重塑。肺动脉平滑肌细胞(PASMCs)内Ca2+稳态失衡和Ca2+超载是导致PASMCs异常收缩、增殖和迁移,并促进肺血管收缩和重塑的重要机制。近年来,一种新型非选择性离子通道Piezo1对细胞内Ca2+稳态的调节作用引起了广泛关注,并被认为在许多心肺血管疾病的发病中发挥重要作用。Piezo1是机械敏感性阳离子通道,可被流体剪切力、机械牵张力或化学物质引起的构象改变激活,并介导顺浓度梯度的Ca2+信号传导。Piezo1是否以及如何参与PAH条件下PAMSCs的钙离子稳态调节,以及细胞的异常收缩、增殖和迁移目前仍不清楚。
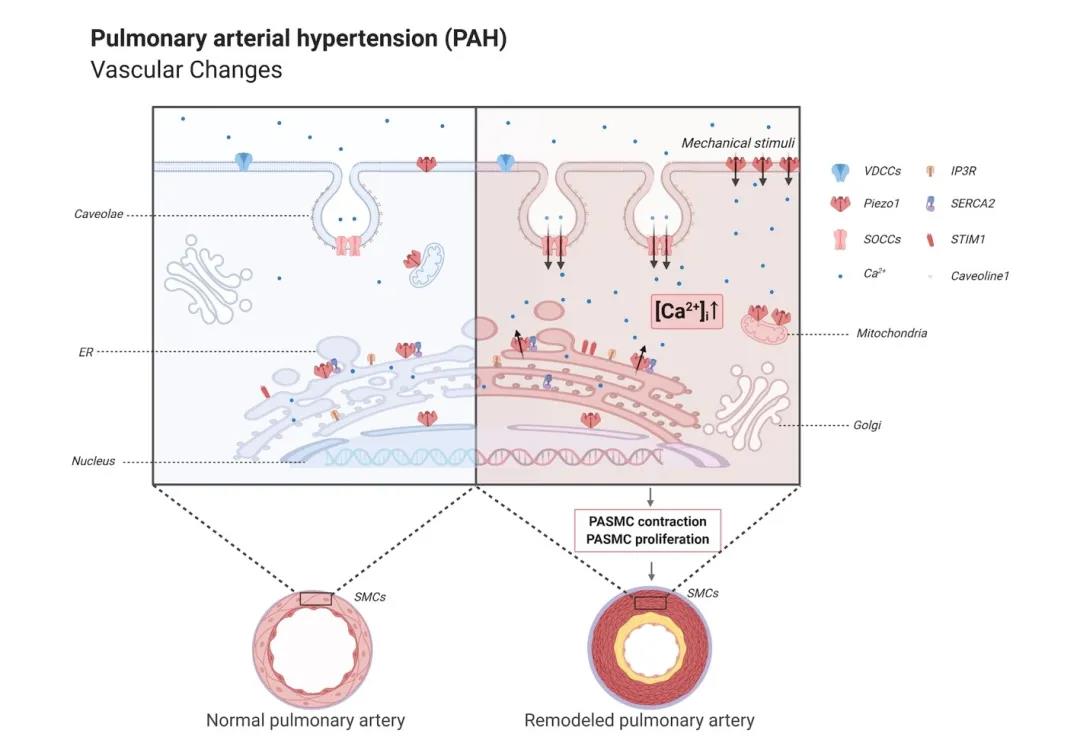
在本研究中,我们首先系统定义了Piezo1介导PASMCs中Ca2+稳态的机制。我们观察到Piezo1可通过两种途径介导PASMCs中[Ca2+]i升高:(1)胞内亚细胞器(包括肌浆网/内质网、线粒体和核膜)定位的Piezo1(Intra-Piezo1)可介导独立于三磷酸肌醇受体(IP3R)和雷诺丁受体(RyRs)调控的胞内Ca2+释放,继而触发细胞膜钙池操纵性钙内流;(2)细胞膜定位的Piezo1(PM-Piezo1)可介导独立于电压依赖性钙通道(L-VDCC)、钙池操纵性钙通道(SOCC)和小凹蛋白(Caveolin-1)介导的胞外Ca2+内流。接着,我们利用细胞实时荧光成像、离体血管环张力及细胞增殖等手段,进一步发现Piezo1活化可介导PASMCs的收缩和增殖。最后,我们发现,相对于健康对照,Piezo1在特发性PAH(IPAH)患者来源的PASMCs中表达与活性均显著增加,提示Piezo1的上调和活化可能是介导IPAH-PASMCs中[Ca2+]i增加并诱导细胞收缩和增殖的重要分子机制。我们的结果为Piezo1在PASMCs中的亚细胞活性和定位提供了一个较为全面的定义,并为PAH伴随的PASMCs钙稳态失衡提供了新理论和新思路。
本研究得到了国家自然科学基金、科技部重点研发计划、教育部长江学者创新团队项目、广东省珠江人才计划本土创新科研团队项目、广东省自然科学基金等基金资助。

2021年3月26日,肺血管病学组王健教授课题组在呼吸领域权威期刊Am J Respir Crit Care Med(医学1区Top期刊,影响因子:17.452)在线发表了题为“NEDD9, a Hypoxia-upregulated Mediator for Pathogenic Platelet-endothelial Cell Interaction in Pulmonary Hypertension”的社论(Editorial)。实验室王健教授为本文的第一作者,美国加州大学圣地亚哥分校Jason X.-J. Yuan教授为通讯作者。
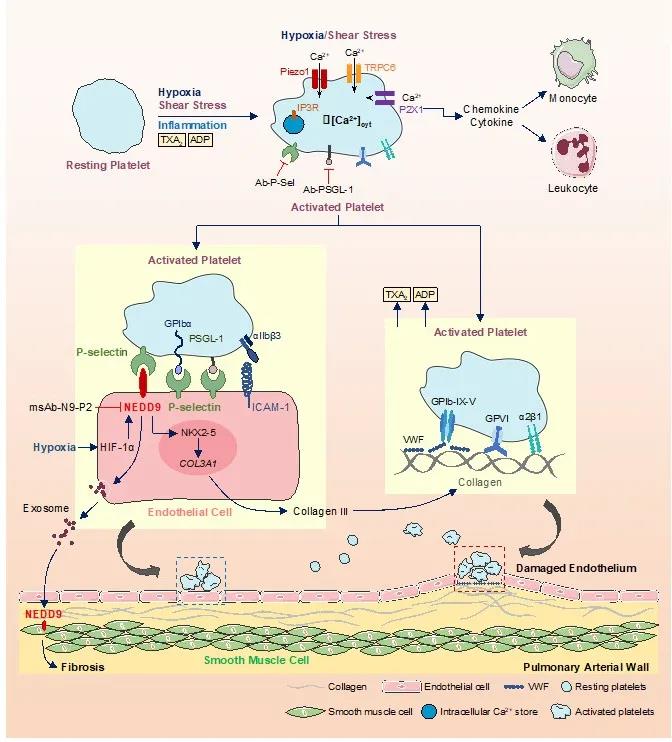
本文总结了近期的研究进展,系统讨论了低氧上调肺血管内皮细胞NEDD9与介导血小板活化的可能分子机制,内皮细胞NEDD9的高表达通过介导血小板/内皮细胞粘附程度的增加促进肺血管血栓栓塞的形成和肺血管重塑。特异性阻断二者的粘附(如特异性抗体或药理学抑制剂)可能是抑制原位血栓形成和血管重塑、并抑制肺动脉高压发生发展的有效手段,有待进一步研究和探讨。